活性酸素種や食物に含まれる親電子性物質などの酸化ストレスは、DNAやタンパク質、脂質などの生体高分子を酸化することで傷害を与えるため、がんや糖尿病などの生活習慣病を引き起こす素因になると考えられています。このような酸化ストレスに対し,細胞はすみやかに生体応答を発動することで、その恒常性維持と適応に努めています。この生体応答の制御機構において、重要な機能を担っているのが、Keap1-Nrf2システムです。私たちの研究室では、生化学・分子生物学的な解析とマウス発生工学的手法による個体レベルの解析,さらには構造生物学的なアプローチも取り入れて、多角的にKeap1-Nrf2システムによる分子レベルの制御機構とその生理機能を解明し、世界をリードし続けています。
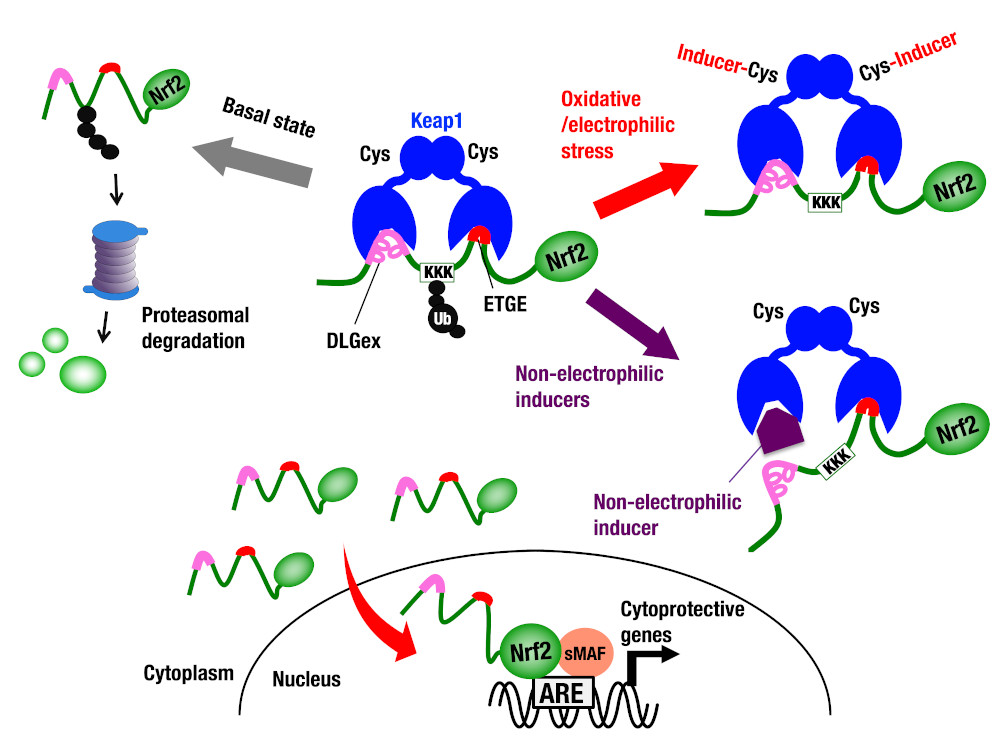
転写因子Nrf2は、ストレスセンサーであるKeap1によるタンパク質分解によって、その活性が制御されています(酸化ストレス応答グループ 鈴木隆史の項参照)。細胞がストレスにさらされると、Keap1による分解が停止し、Nrf2は核へと移行して、小Maf群因子と二量体を形成します(勝岡の項参照)。Nrf2-sMaf二量体は、DNA上のCNC-sMaf結合配列に結合し、標的遺伝子の発現を活性化します(大槻の項参照)。Nrf2の標的遺伝子には、解毒代謝酵素群や酸化ストレス防御遺伝子が含まれており、これにより細胞は毒物や酸化ストレスから防御されています(枝光、池畑の項参照)。また、Nrf2は、微小重力や宇宙放射線からのストレス防御にも貢献していることが、最近の私たちの研究から明らかとなりました(鈴木隆史の項参照)。Keap1-Nrf2システムの活性化は、糖尿病やアルツハイマー病など様々な疾患に改善効果をもたらし、Nrf2活性化剤がこれらの疾患の新たな治療薬として期待されています(宇留野の項参照)。Keap1-Nrf2システムは生体防御に働く一方で、がん細胞に治療抵抗性を与えることがわかっており、その治療法開発にも取り組んでいます(Bairdの項参照)。
詳細は下記をご覧ください。
|
| 
